
分析方法学验证(analytical method validation)的目的是证明建立的方法适合于相应检测要求。在建立药品质量标准、变更药品生产工艺或制剂组分、修订原分析方法时、需对分析方法进行验证。
简介
根据《药品注册检验工作程序和技术要求规范(试行)》要求对受理的药品注册检验申报,需要进行注册标准复核。药品检验机构参照《中国药典》、WHO或ICH等国际机构的有关技术要求和技术指南,对申请人申报的药品质量标准中检验项目及其标准设置的科学性和合理性、检验方法的适用性和可行性进行评估。
服务流程

检验项目和验证指标

注:+表示通常需要验证的参数;-表示通常不需要验证的参数。
服务优势
1. 全面的实验平台:具备Sanger测序、毛细管电泳、荧光定量、数字PCR及NGS平台,可针对不同的检测需求选择最适用的平台服务。
2. 丰富的项目经验:多项定量及定性方法学验证项目执行经验,包含细胞STR指纹图谱分析、干细胞体内分布检测、mRNA疫苗残留检测、基因分型Sanger测序验证等。
3. 合格的质量体系:阅微基因在ISO9001、ISO13485质量体系框架下进行人员培训及环境、设备校验,是保障项目验证质量的基础。
4. 以客为本的服务态度:根据客户项目需求,结合自身项目经验提供相应方案设计,从售前到售后全面沟通落实。
合作案例
定性方法学验证案例
客户需要对使用STR技术进行细胞鉴定的方法进行方法学验证:

专属性确认存在外来成分也不会干扰试验而影响结果;供试品至少重复进行3次都能检出的最低量作为检测限;相同实验条件变更实验人员,实验地点等结果无误验证表明具有重现性;更换仪器和微小参数结果相同来证明其耐用性。
定量方法学验证案例
客户需要对qPCR技术检测干细胞在患者外周血内的残留量的方法进行方法学验证:

标准曲线,其R2≥98%,扩增效率在90%-110%范围内;准确度在15%范围内,对于定量下限准确度在20%范围内;同时重复试验其SD均值、CV均值,合格判定标准为变异系数不超过15%,定量下限的变异系数不超过20%范围。
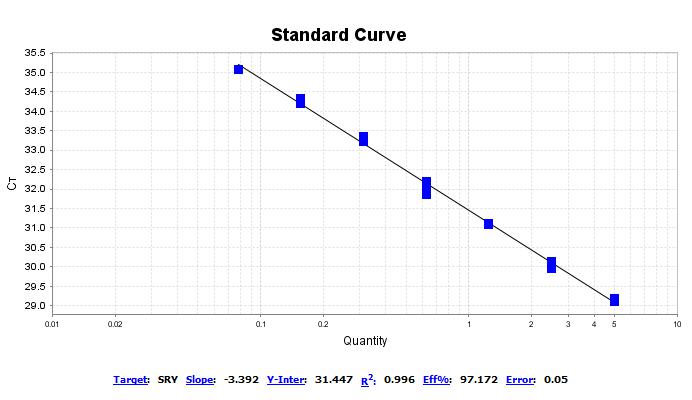
qPCR标准曲线图
参考资料
1. 生物制品质量控制分析方法验证技术审评一般原则. 【S】GPH1-1
2. 药品注册检验工作程序和技术要求规范(试行). 2020年版
3. 《中国药典》. 2020年版
2. 药品注册检验工作程序和技术要求规范(试行). 2020年版
3. 《中国药典》. 2020年版






