
简介
传统的高通量测序技术被广泛应用于研究不同组织/品种/处理/时间点等样本,但多是反映特定组织/细胞集合的基因表达平均水平或者代表性信息,单个细胞特异性的信息往往被掩盖,导致错失很多重要信息。10x Genomics Chromium系统利用微流控技术分选单个细胞后将细胞分配到油包水微反应体系中,并通过每个微反应体系中含有的特定DNA标记序列(10x barcode和UMI )区分不同单细胞和转录本,可实现单细胞分辨率上的各类测序。其适用于多种细胞类型,包括生殖细胞、胚胎细胞、血细胞、神经细胞、肿瘤细胞、免疫细胞、干细胞等。

技术流程

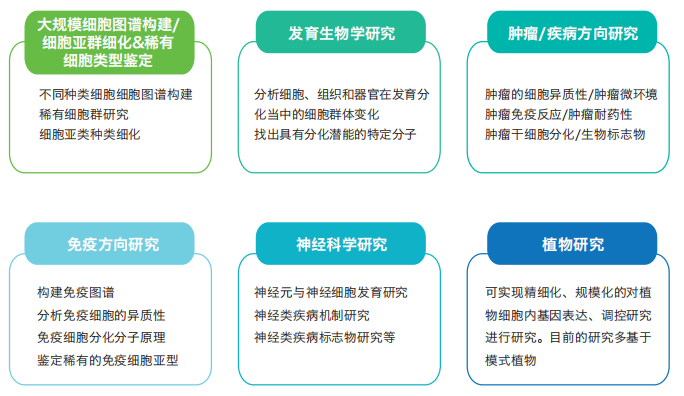
应用领域
服务优势
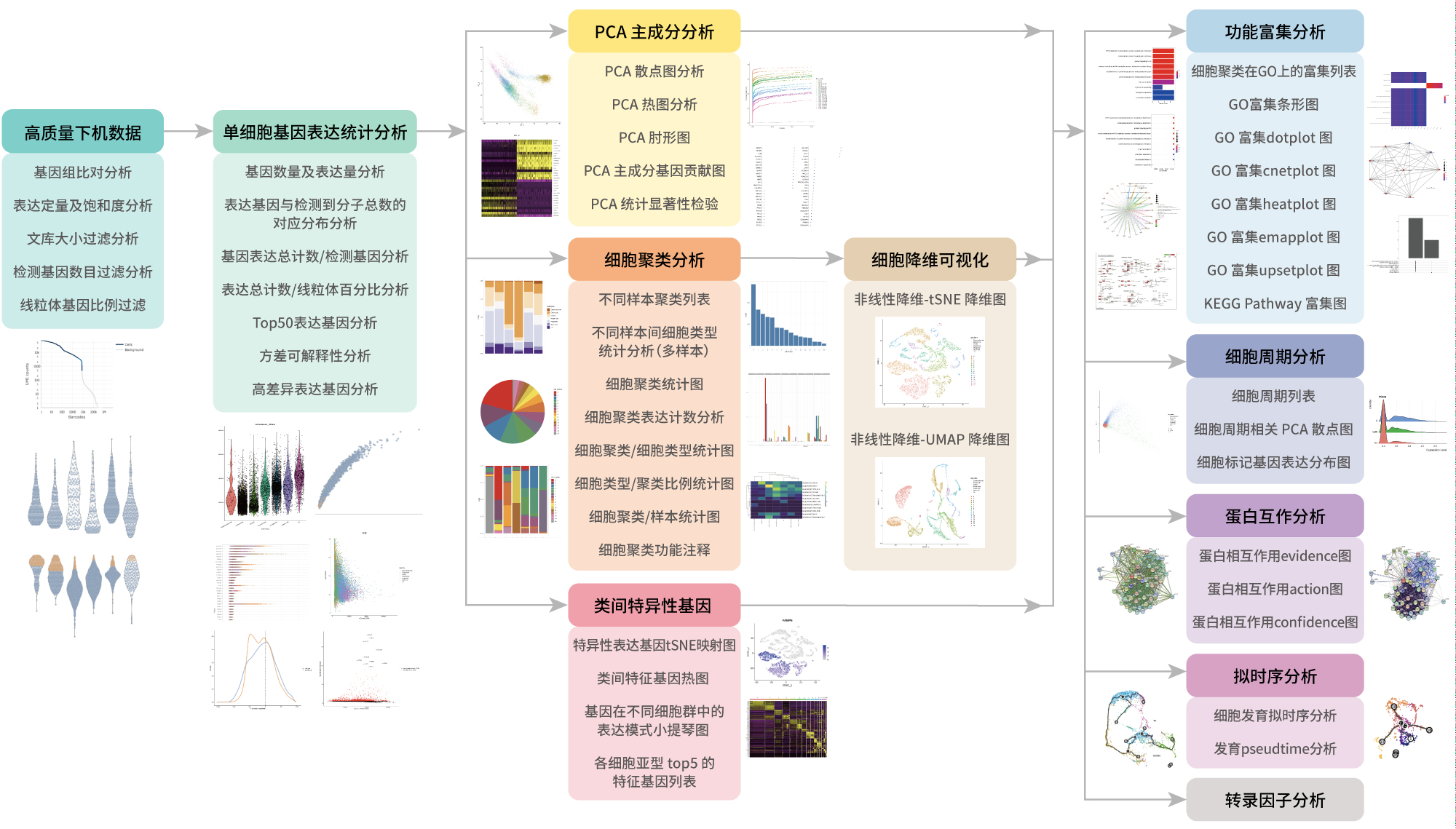
生信分析流程
客户常见问题
Q1:请问流式细胞分选和试剂盒分选哪个适合用于制备单细胞悬液?
流式细胞分选是经典的方法,只要有相应抗体就可以完成分选。但在实际细胞分离当中,由于流式分选价格相对昂贵或设备限制,实验者会考虑采取其他方法分离细胞,试剂盒分选就是其中之一。
与流式分选相比,试剂盒也能够高效、简便地完成目的细胞分选,极大地提升了可操作性和节省时间成本。目前市面上推荐的试剂盒通常是磁珠+特异性抗体结合的方法,例如美天旎品牌的磁珠分选,其技术水平成熟,已可用于临床应用。例如,从人或小鼠组织中可分选出纯度高达95%的naive CD4+ T细胞,且分选出的细胞活性高,活化状态及功能不受影响。
当然,利用试剂盒分选的前提还是必须有适于分选目标细胞类型的产品,并进一步确认其分选的效率、时间等因素。
值得注意的是,下面列出几种其它细胞分离方法不能替代的情况,这些情况下必须进行流式的细胞分选:
1、要求目标细胞群有极高的纯度(95%~100%);2、需要分离低密度表面受体/抗原的细胞(弱阳性细胞);3、需要根据表面受体密度的差别来分离不同细胞(根据免疫表型的分选,抗体亲和力进化等);4、需要依据多色荧光标记来分选细胞;5、根据某些细胞内部标志,如DNA含量、胞内抗原等分离细胞;6、多孔板分选:如单克隆分选,在96孔板每个孔中精确分选进1个细胞;7、需要分选极低含量的细胞(如0.001%或更低),流式可以分选出百万分之一的稀有细胞。
Q2:为什么一个样本中只提取6K~8K个细胞来进行测序?是目前技术限制吗?有些组织可能会含有上百万个细胞,只提取其中少量细胞进行测序是不是覆盖面不够?
上文提到,10x Genomics捕获到每个样本的细胞是最多为1万,现在10x的技术,细胞数量再进一步增加会使油滴中多细胞的概率大大上升,影响到后续数据质量。根据我们的经验和文献当中单个样本捕获到的细胞量综合考虑,一个样本捕获6K-8K个细胞是成功率高且最为稳妥的方法。
6K-8K细胞的覆盖率确实是有限的,然而我们可以通过将一个样本分成多个样品进行建库来增加测序的总细胞量。而测序总细胞量越多,可分析到的内容就越全面。但同时,经费成本也成倍增加。所以需要视研究目的来进行方案选择。比如目的是进行组织中单细胞表达图谱构建,想尽可能地覆盖到更多细胞类型时,细胞量必须多一些,则每个样本可以制备2个建库样品。而如果是想比较不同疾病间某类型细胞基因表达差异时,如果该细胞在组织中的丰度尚可,则6K-8K个细胞便能满足。
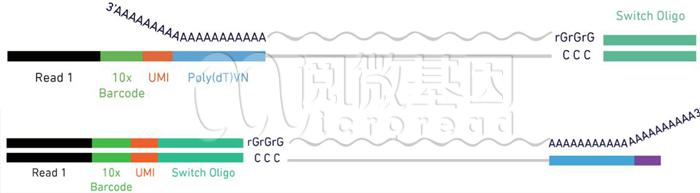
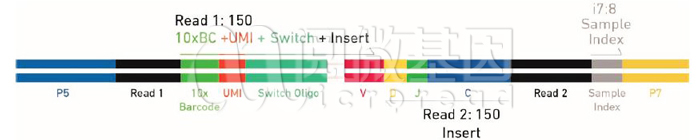
Q3: 请问单细胞建库方法5’端和3’端捕获有什么区别?为什么VDJ通常用5‘捕获?
10x单细胞转录组建库有5‘端和3’端建库两种方式。在3’端的建库中,Gel beads的末端序列是poly(dT),用于和转录组3’端的polyA结构互补配对。而在5’端的建库中,Gel beads的末端序列是TSO序列,其末端有polyG的结构。转录本会在酶的作用下在其5‘端加上polyC的结构,由此完成配对。
Q4: 单细胞转录组测序在取样时是否可以取癌组织部分和癌旁组织,混合成一个样?还是必须分开来测,算作两个样?这样的情况目前发表的文章里面出现过吗?
样本是否能够混在一块要看老师的研究目的。若是老师的目的是想比较正常组织与癌症组织的差别,那么最好分做两个样本。若是经费问题老师想混在一块的话混合比例还是一个问题;若是老师想看癌症的发展历程,则可用单个癌症组织,因为癌症组织中也含有正常细胞,早中晚期各个阶段的细胞。






