基因治疗技术瓶颈怎么破:“以毒攻毒”?
如何把治疗疾病的DNA导入患者的人体细胞,成为基因治疗面对的第一道难题,也成为其发展的技术瓶颈。为此,科学家和医生们很快想到,可以利用一种极为有效的天然工具——病毒来寻求突破。
通过寻找天生能够进入特定类型人体细胞的病毒,并对其加以改造,科学家试图在尽量消除其致病性的同时把所需运载的治病DNA放进去。如此顺理成章的方法,是否就能够帮助人们实现基因治疗了呢?没错,人类由此迎来了医学史上的又一座“里程碑”,但这一切还仅仅只是开始。
王立铭(浙江大学生命科学研究院教授、研究员,国家青年千人计划和浙江省千人计划入选者)
在“基因治疗的前世今生”系列文章第一篇中(回复编号“354”提取全文),咱们说到了基因治疗的第一个技术瓶颈:如何把治疗疾病的DNA导入到病人的细胞里去。人工方法不那么管用,于是科学家转而求助大自然的力量。
病毒:细胞定位“专业户”
所谓求助大自然的力量当然不是求神拜佛,科学家和医生手中的武器,是有点耸人听闻的病毒。
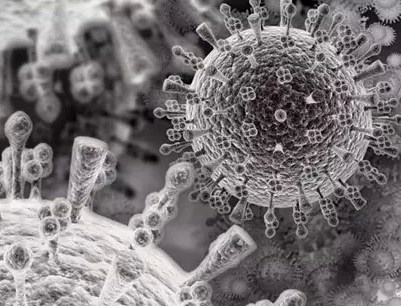
作为最简单的生物,病毒有一些非常特别甚至堪称奇葩的特点。病毒是地球上最微小的生命物质,大多数病毒的直径仅有200到300纳米,上百个病毒堆叠起来,其大小还比不上我们常说的“微生物”细菌。在这么小的尺度上堆叠起有机生命是异常困难的,然而漫长的进化史,留下了“极简+最优化”的设计蓝图。我们用大家耳熟能详的流感病毒来做说明吧:首先,一个蛋白质颗粒紧密连接形成空心球壳,球壳内部保护着病毒的遗传物质(对于流感病毒来说,这些物质是有核糖核酸RNA分子构成的,也有以脱氧核糖核酸DNA分子构成的病毒),而球壳外侧则包裹着一层来自宿主细胞的膜结构。病毒的遗传物质更是被精简到不能再精简——流感病毒一共只有11个基因。换句话说,依靠病毒本身的遗传物质,它只能编码合成11种蛋白质!
区区11种蛋白质其实是远不足以支撑一个有机生命的。举例来说,寄生在我们肚子里的微生物大肠杆菌,有4400个基因来维持它的生理机能,如获取营养、排泄废物、生长繁殖、应对危险等。那么,病毒是怎样靠如此精简的遗传信息存活繁衍的呢?这就要提到病毒的第二个特别之处了。无机环境中的病毒颗粒,其实可以被当做非生命来对待,比如空气中、土壤里、水里的流感病毒颗粒,它们本身不会进行任何新陈代谢、生殖繁衍,如果保存条件合适,病毒颗粒可以一成不变地存在下去。只有当病毒进入到其他生物的细胞里(称为宿主细胞,可以是动物、植物,甚至可以是细菌或者其他病毒)之后,才会借助宿主细胞的生命机能,开始自己所有的生命活动,甚至包括繁衍后代都需要宿主“帮忙”。病毒是真正字面意义上的“寄生虫”。
这篇文章毕竟不是讲病毒的,因此,对于病毒究竟是如何利用宿主实现自身生存和繁衍的,笔者就不再展开了。上文所述,主要是为了强调一件事:基于那些理由,病毒找到并进入宿主细胞,便成为病毒生活中的头等大事。如果科学家和医生们需要找到一种工具,以帮助他们打开并进入病人的细胞,病毒自然将成为首选,人家多少亿年就是练这个的!
咱们还是说回流感病毒。流感病毒主要的侵袭对象是人类呼吸道的上皮细胞,比如鼻子、喉咙、肺部的细胞。打一个携带着流感病毒的喷嚏,上百万的病毒颗粒就随着飞沫扩散开来,如果您恰好在附近,那么很有可能在不知不觉中,成百上千的病毒颗粒就已经附着在您的敏感部位了。接下来,病毒又是如何找到自己的“真命”宿主的呢?
我们的上皮细胞表面有一种叫做唾液酸(sialic acid)的糖分子,它们的一大功能是帮助上皮细胞抓住水分子,保持表面湿润。这种糖分子对于细胞吸收水分也很重要。而流感病毒所编码的11个蛋白之一 ——名为血凝素的分子(HA,hemagglutinin)恰恰可以准确地结合唾液酸。这样一来,流感病毒颗粒就可以准确地把自己定位到未来的宿主细胞上。更妙的是,血凝素和唾液酸结合之后,宿主细胞会误认为自己的表面结合到了值得拥有的营养物质,于是宿主细胞就启动了吞噬营养物质的程序,“主动”把病毒颗粒吞到了自己体内。而等到病毒在细胞里为所欲为、复制繁衍之后,新产生的病毒仍会被唾液酸—血凝素给牢牢绑定在宿主细胞上。怎么办?这时候,就该11个蛋白中的另外一个——神经氨酸酶(NA, neuraminidase)上场了。神经氨酸酶能够切断唾液酸—血凝素的连接,于是,新生的病毒又可以自由自在地扩散,甚至通过飞沫传到更多的人身上。
而这一切的发生,仅仅是在百分之一根头发丝大小的方寸之间,参与者不过区区11个蛋白!
禽流感病毒的电子显微镜照片。表面突起的,就是血凝素和神经氨酸酶分子。顺便说一下,大家从新闻里看到的诸如H1N1、H5N1之类对流感病毒的编号,其依据就是对血凝素(HA)和神经氨酸酶(NA)的分类,因为对于流感病毒来说,到底侵染什么样的宿主、侵染能力有多强,主要就是由这两个蛋白质的特点所决定。
科学家的废物利用工程
说完病毒,让我们言归正传,回到基因治疗的话题。
鉴于大自然已经给我们准备了定位和进入细胞的“专业户”,科学家们相应的构思就是,也许我们可以找到一种天生能够进入特定类型人体细胞的病毒,对它加以改造,在尽量消除其致病性的同时把我们需要运载的治病DNA放进去,如此一来,是不是就可以帮助我们实现基因治疗了?
让我们以世界首例基因治疗为案例,讲讲实现治疗的过程。
此前我们讲到,治疗重症联合免疫缺陷症(ADA-SCID)的最要紧之处,在于让患者的白细胞恢复产生正常腺苷脱氨酶的能力,为了达到这个目的,我们需要把正确的ADA基因放回患者白细胞的基因组DNA之上。
因此,我们首先需要的是一种能够帮助定位和进入人类白细胞的病毒,这倒也并非难事。自然界存在相当多数量的专门依赖人类白细胞的病毒,臭名昭著的人类免疫缺陷病毒HIV便是其中之一,其侵染的对象是人类数种淋巴细胞并因此破坏人类的免疫机能。当然,出于安全性的考虑,使用其自身能够侵染人体并导致疾病的病毒是不太合适的。最终,科学家选定的是一种名为“莫罗尼小鼠白血病病毒”的家伙(MoMLV,moloney murine leukemia virus)。事实上,过去20多年里,超过四分之一的基因疗法临床试验都利用了这种病毒。该病毒能够高效侵染啮齿类动物的淋巴细胞并且导致白血病,但是,对人类淋巴细胞的侵染能力和致病性相对来说要好控制得多。
其次,我们还需要继续降低这种病毒的潜在风险。我们已经知道,病毒进入宿主细胞以后,并非只是“活雷锋”一般帮助我们运送治疗疾病的物质。病毒的主要任务还是疯狂地复制繁衍后代,然后离开宿主细胞,开始下一轮的生命周期。为了确保安全性,美国国立卫生研究院(NIH)的William French Anderson医生在1985年首先尝试了改造MoMLV病毒:他与合作者把MoMLV病毒基因组RNA上编码病毒球壳的蛋白一律删除掉。这样一来,MoMLV侵染进入细胞后,无论如何复制,都没有办法产生后代所需要的病毒球壳,因此也就失去了繁殖和继续侵入其他细胞的能力。
第三步,当然就是把正确的人类ADA基因放入MoMLV病毒的基因组。顺便说一句话,MoMLV属于所谓的“逆转录病毒”,它的遗传信息是由RNA而不是高等生物常用的DNA编码的。进入细胞后,RNA会被病毒自身携带的逆转录酶(reverse transcriptase)变成DNA,并同时插入到宿主细胞的基因组DNA上。病毒当然是利用这个过程把宿主细胞变成自己的永久驻地,可以无休止的产生后代,而医生们则恰恰是希望利用这一特点,把病人所需要的“救命基因”永久性地放入病人细胞内。1986年,Anderson医生和同事们已经用这个方法证明,在体外培养的动物淋巴细胞可以被重新植入ADA基因,并恢复产生腺苷脱氨酶的能力。而在其后数年中,Anderson医生又在从小鼠到绵羊的大小动物体内进行了类似的实验,万事俱备,似乎只等这项技术用于挽救人类患者的那一天了。
莫罗尼小鼠白血病病毒的结构模拟图。特别值得指出的是,这种病毒是一种逆转录病毒。进入细胞后,病毒携带的逆转录酶会将病毒RNA逆转录成为DNA分子并插入宿主基因组中,这使得病毒的遗传信息可以永久性的存在于宿主细胞中并且持续的复制并产生后代。也正是类似的机理,使得科学家可以利用这种病毒帮助我们将治病基因永久性的引入患者细胞中。地球生命几十亿年的进化,为生物学家准备了大量可以用来改善我们自身健康的利器。
1990年:里程碑式的“开始”
1988年6月起,完成了动物实验的Anderson医生就开始寻求美国食品药品管理局(FDA)的批准,希望将这项技术用于临床,治疗罹患重症联合免疫缺陷症的患者。经过漫长的审查和等待、数不清的会议以及长达20小时的公开听证会之后,Anderson医生于1990年2月23日得到了进行人体试验的许可。很快,他们遇到了4岁的小女孩Ashanti DeSilva和她焦虑的父母。
和所有重症联合免疫缺陷症的患者一样,DeSilva的免疫功能几乎被完全摧毁了。从出生起,她每年都在遭受无休止的耳道感染、肺部感染、鼻腔感染的困扰,四岁的她身高体重只有正常两岁孩子的水平。客观地说,即便是在上世纪80年代,对于重症联合免疫缺陷症也还是有治疗方法的:一是“头痛医头”式的定期注射长效腺苷脱氨酶蛋白,二是“釜底抽薪”式的骨髓移植,换来正常合成腺苷脱氨酶的细胞。然而这两种方法都失效了,DeSilva开始对腺苷脱氨酶注射失去反应,同时根本找不到合适的骨髓配型用于治疗。
于是,就像人类历史上许多里程碑式的事件一样,DeSilva的父母在绝望中做出了无奈地选择,让DeSilva接受新疗法带来的命运未知的挑战。
1990年9月,在长达12天的治疗周期中,Anderson医生和合作者们首先从DeSilva体内抽取血液,提取其中的白细胞(特别是一种叫做T细胞的淋巴细胞),然后利用改造后的MoMLV侵染这些细胞,进而将功能正常的ADA基因插入它们的遗传信息中。9月14日下午12点52分,医生们用颤抖的双手打开阀门,把改造后的白细胞重新输回DeSilva体内。
1990年底,Anderson医生在刚刚创刊的Human Gene Therapy杂志上撰文,用简单的“开始”一词,描述这一历史性的时刻。
“开始”几个月之后的1991年,另一位罹患重症联合免疫缺陷症的11岁女孩Cindy Kisik,在同一家医院接受了Anderson医生团队几乎完全相同的基因治疗,手术取得成功。
1992年底,美国密歇根大学医学中心的James Wilson医生宣布,他的团队成功治疗了一名患有家族性高胆固醇血症(familial hypercholesterolemia)的29岁女性。在治疗过程中,医生们取出患者的肝脏细胞,并利用腺病毒载体(AAV8)将患者所缺乏的LDL受体基因重新引入细胞,再将细胞植入患者体内。数月之内,患者体内的胆固醇水平得到了显著控制。完全不同的患病基因,完全不同的病毒载体,完全不同的人体细胞,但是基因疗法又一次成功了。
患者、医生和科学家的热情迅速被点燃,临床试验在美国、欧洲、中国、南美的许许多多医学机构中被迅速设计出来并得以开展。不到10年时间内,在近千起临床试验中,有上千位病人接受了基因治疗,所涉及的疾病不断增加,而相关的治疗工具也日益得到扩充。
许多人真诚地相信,基因治疗的时代到来了。
历史的背影
第一例接受基因治疗的患者Ashanti DeSilva今年29岁,仍然健康快乐地生活着。2013年,她和世界上第二位基因疗法的获益者CindyKisik参加了美国免疫缺陷基金会年度会议,并且和当年参与实施治疗的Michael Blaese医生合影留念。
至于亲手开创基因治疗时代的Anderson医生本人,则在2007年因性侵一名14岁的少女而锒铛入狱,至今仍在服刑。他的所有学术职位、研究工作,也包括他曾经震惊世界的伟大成就,都已成过眼烟云。
2013年,DeSilva(左)、Kisik(右)和Blaese医生合影。两位当年疾病缠身的小女孩已经长大成人。
至此,基因治疗的第一个瓶颈——让治病DNA高效进入人体细胞的难题已经迎刃而解,人们可以欢呼基因治疗的胜利了呢?
是,也不是。病毒确实为基因治疗提供了一种相对低风险、高效率的手段,但仅仅在10年之后,接踵而至的两场悲剧便给了基因治疗的拥护者们当头一棒。病毒载体的两个顽固特性带来的严重安全风险,为基因治疗的光明前景蒙上了一层阴影。直到今天,这层阴影也还没有完全消散。






