验证升级丨慢病毒插入位点检测增加国际标准品测试!
去年年底FDA公布调查CAR-T疗法的安全性问题—T细胞癌症风险的出现被认为源于其使用的基因递送载体-慢病毒载体后,于今年1月31日正式发布“ Considerations for the development of Chimeric Antigen Receptor (CAR) T Cell Products”指导原则。当中建议根据风险评估来确定载体拷贝数(VCN)的放行标准。 风险评估包括插入位点分析、克隆优势、剂量、适应症、研究人群等研究支持的实验数据。

慢病毒插入位点检测(LM-PCR法)准确性通过国际标准品检测验证
阅微基因慢病毒插入位点检测项目采用LM-PCR法,检测3’LTR+5’LTR双端文库,结果可相互补充印证。项目上市前已通过真实单、寡克隆CAR—T细胞阳性品,严格按照《中国药典》要求对其准确性、检测限、线性、重现性以及数据量做了系统的方法学验证。项目上市以来,已与多家企业达成了深度合作。 近日,更近一步对WHO慢病毒插入位点标准品(NIBSC)进行了检测,通过国际标准品的检测数据评估检出率和准确性。该标准品在13个国家的31个实验室进行了测试,其中下列10个位点在大部分的实验室中被报道。
结果显示:准确率达100%,检出率高达90%,表明该项目的准确率和检出率准确可靠。

LM-PCR(Linker-Mediated PCR)使用特异性linker与引物,在全基因组层面对插入位点进行精准富集。实验原理如下:将基因组DNA使用超声随机打断,对打断产物进行末端补平,加A后连接Linker,使用特异性引物进行两轮PCR扩增富集建库后测序分析,对插入位点可能引起的基因风险进行评估。经验证,占比达1%的细胞克隆可准确检出,诺华 Kymriah及强生 Carvykti上市向FDA提交的插入位置安全性评估也是基于此技术进行检测的。
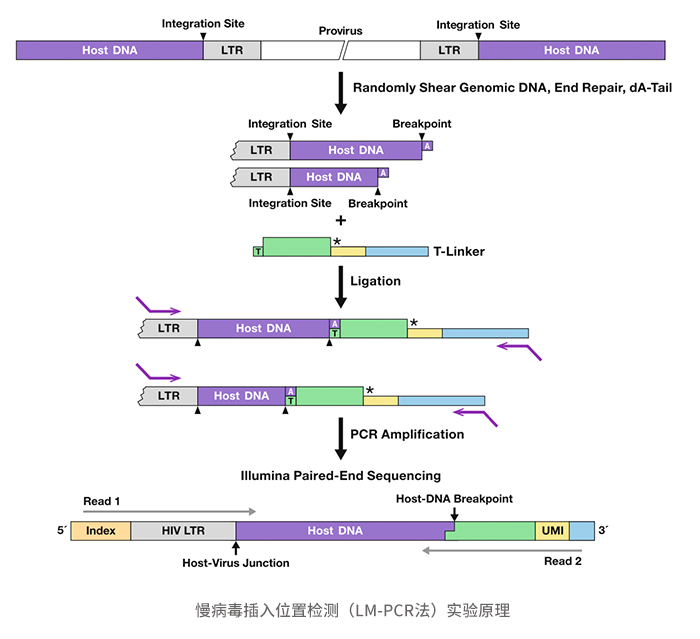
阅微基因慢病毒插入位置检测的方法学验证
按《中国药典》要求对各项性能指标进行的系统性方法学验证内容及结果如下:

项目结果报告内容展示

质量控制是产品安全、有效的重要保证和产业化进程中的重要环节之一,阅微基因可提供细胞特性、功能性、纯度、安全性等分析,从药典推荐方法到快速检测方法满足不同阶段的研发需求,同时为研发型药企及CXO企业提供从质控、基因分析到临床基因分型方法的验证开发。

参考资料
1.《基因治疗产品非临床研究与评价技术指导原则(试行)》. 2021年版
2.《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》. 2021年版
3.《基因治疗产品长期随访临床研究技术指导原则》. 2021年版
4.《嵌合抗原受体T细胞(CAR-T)治疗产品申报上市临床风险管理计划技术指导原则》。2021年版
5. 《中国药典》. 2020年版
6. 《Considerations for the development of Chimeric Antigen Receptor (CAR) T Cell Products》2024年版







