北京成为注册人制度试点,可委托京津冀生产
2月22日,中华人民共和国中央人民政府发布《国务院关于全面推进北京市服务业扩大开放综合试点工作方案的批复》(国函〔2019〕16号)第5条规定:“开展医疗器械注册人制度试点,允许北京市医疗器械注册人委托京津冀地区医疗器械生产企业生产医疗器械,助推“注册+生产”跨区域产业链发展。”
已经实施注册人制度的地区
上海市
2018年1月10日,原国家食品药品监督管理总局发布《总局关于上海市食品药品监督管理局开展医疗器械注册人制度试点工作的公告》(2018年第1号)文件,标志着上海市成为国内首个注册人制度试点,2月27日上海远心医疗科技有限公司的单道心电记录仪,获得由上海食药监局颁发注册人制度施行后的首张第二类医疗器械产品注册证。
上海后续公示的获批企业中,陆续有企业获得注册证,这些企业都已经公示了委托生产企业,展示在备注或变更备注栏中,详情如下图所示:

广东省
2018年8月16日,国家药品监督管理局发布《国家药品监督管理局关于同意开展医疗器械注册人制度试点工作的批复》(国药监函[2018]42号)文件,标志着广东成为第2个试点。9月29日,广东食品药品监督管理局为深圳迈瑞科技有限公司颁发广东省医疗器械注册人制度施行后的首张第二类医疗器械产品注册证。
天津市
2018年8月16日,国家药品监督管理局发布《国家药品监督管理局关于同意开展医疗器械注册人制度试点工作的批复》(国药监函[2018]43号)文件,自此天津市成为国内第3个注册人制度试点。
注册人制度带来的主要变化
主要改革
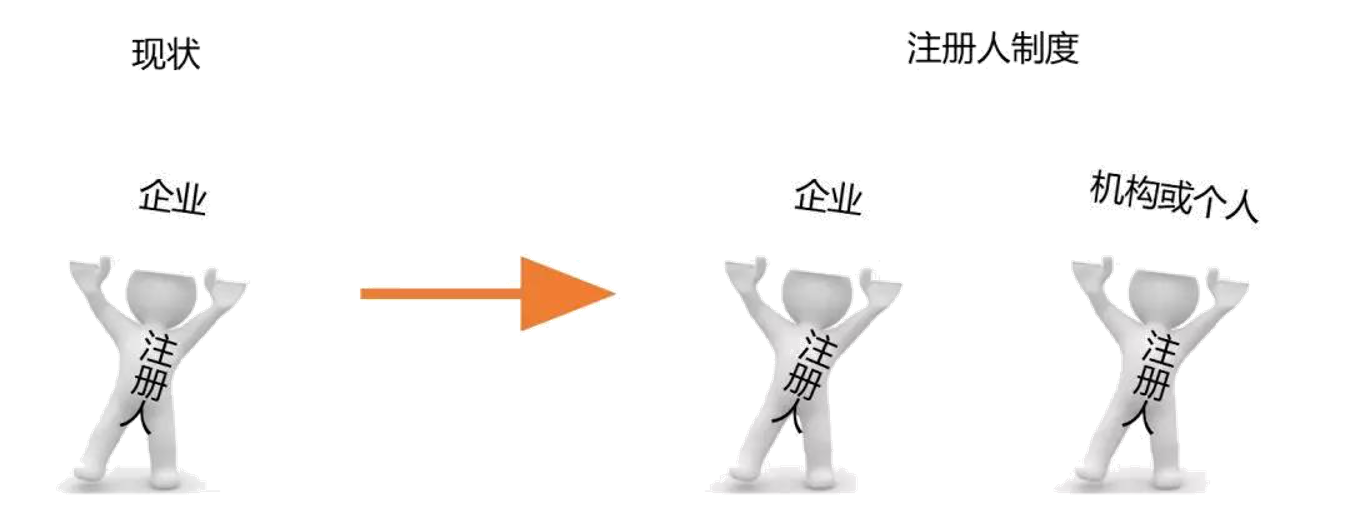
中国医疗器械监管现行政策实行产品注册和生产许可“捆绑”的模式,医疗器械产品上市必须由自己研发自己生产,委托生产只允许双方同时具备医疗器械注册证和生产许可证的企业才可以申请办理。
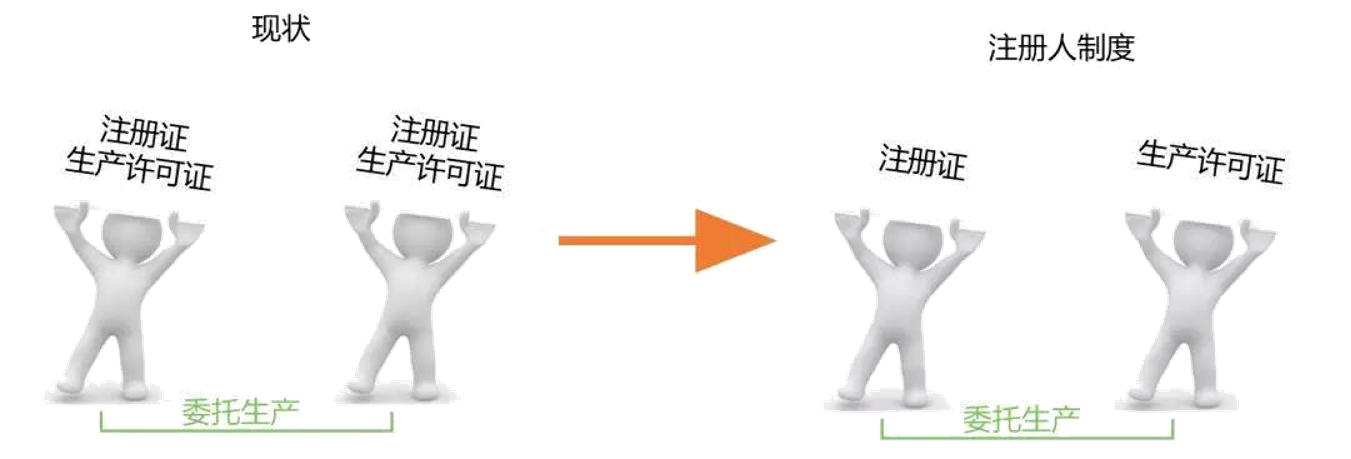
实施注册人制度将为产品注册和生产许可“解绑”,如下图所示:
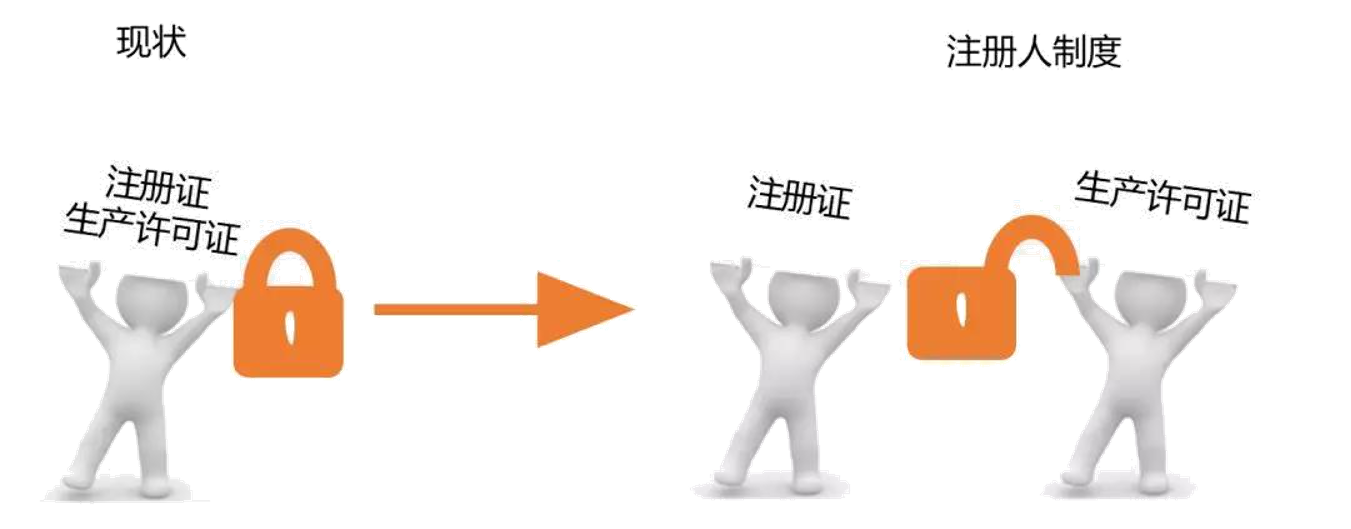
注册申请人取得医疗器械注册证后,成为注册人。医疗器械注册人对全生命周期产品质量承担全部责任。
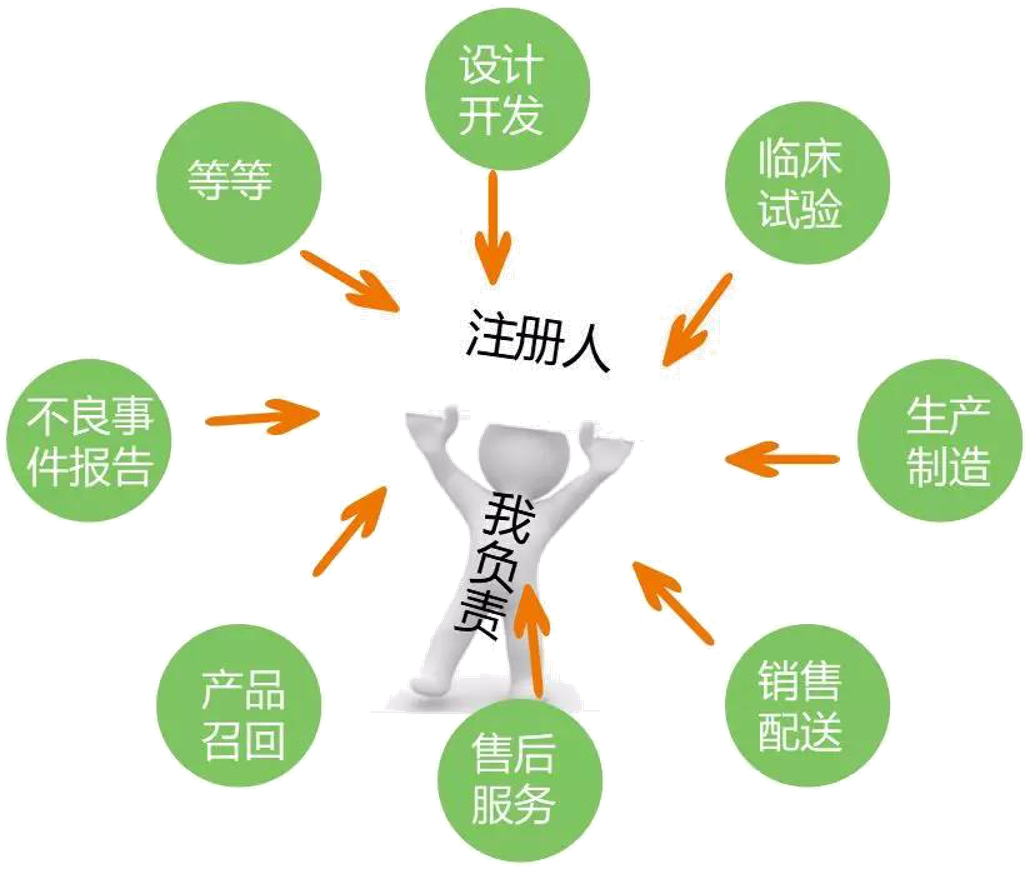
将技术交付给受托人之后,不能不闻不问。必须要起到监督审查的责任,避免产品在生产环节出错。确保对上市医疗器械进行持续研究,及时报告不良事件及其风险评估情况,提出并落实处置措施。
受托人应履行《医疗器械监督管理条例》及其他相关法律法规以及委托合同、质量协议规定的义务,并承担相应的法律责任。对有问题的产品需要及时对产品进行召回,并告知注册人和监管机关。
接受注册人监督,确保医疗器械符合国家质量标准。
主要改革措施:
一是医疗器械注册申请人可委托试点内具备相应生产条件的企业(即受托企业)生产样品。突破了现行法规只有原国家食品药品监督管理总局认定的创新医疗器械产品样品才可以委托生产的规定;
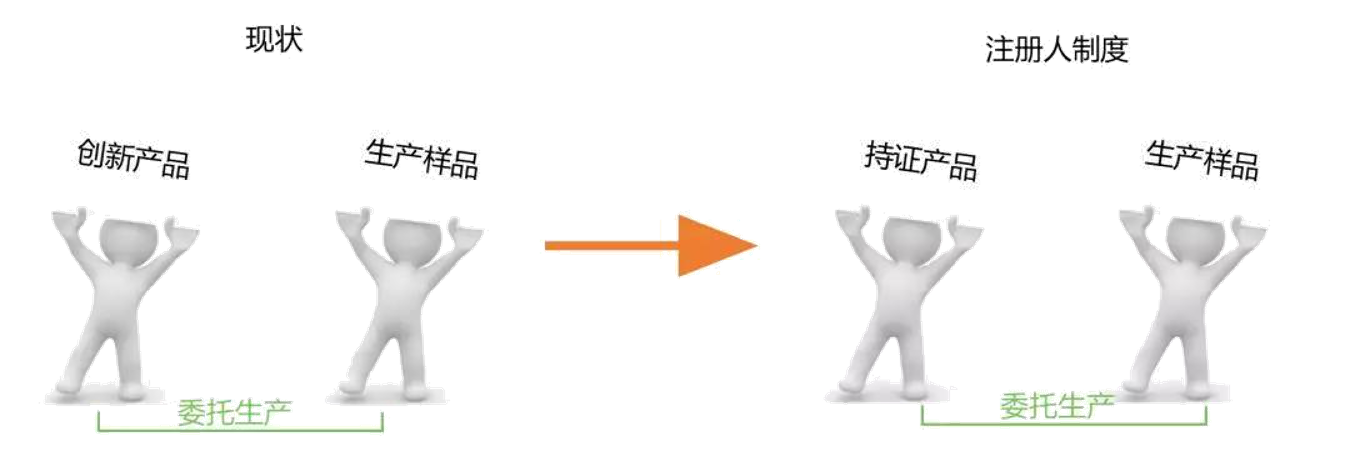
二是注册人除可自行生产外,还可以委托生产,且可以同时委托多家企业生产。
此次改革主要为了鼓励注册人专注于提高产品研发和技术更新能力,如果本身不具备生产力,可以委托给试点内符合资质的企业进行生产,这是对我国医疗器械行业的一次重大变革。
值得注意的是:注册人需要具备承担医疗器械质量安全责任的能力,不仅可以是企业,也可以是机构和个人。
审批周期
周期的缩短有利于节省企业成本,我国医疗器械产业高速发展后,产能过剩逐渐成为显著问题,越早通过注册,也可以越早的投入生产。
转自:CMDRA







