嵌合抗原受体(CAR)和T细胞受体(TCR)修饰的T细胞是当前过继性细胞治疗技术(Adoptive Cellular Therapy,ACT)中两大核心技术,通过工程化编辑使得T细胞表达人工合成受体并具有特异性识别靶细胞的能力,可实现对血液相关肿瘤(如白血病和淋巴瘤)的长期缓解甚至治愈,正在彻底改变癌症的治疗方法。
单细胞测序技术在近些年兴起,让科学家们可以在单个细胞的分辨率上了解其转录组表达特征和免疫组库信息,已被广泛地运用在肿瘤、系统发育和各类疾病的研究中。目前科学家们已经开始利用单细胞测序技术进行CAR-T与TCR-T的研发与治疗效果评估。本文分享两篇最新文献来阐述这一研究应用。
单细胞测序在工程细胞治疗中的应用场景概况
1. 评估输注前工程细胞制品治疗或编辑效率
2. 探究输注前后的增殖与克隆情况
3.探究输注前后不同阶段细胞基因表达的变化
4. 探究输注前后细胞类型与克隆、增殖和疗效间的关系
5. 探究体内工程细胞实际作用情况与机制,提供工艺改进参考
单细胞测序探究输注前后CD19 CAR-T细胞克隆动力学
Clonal kinetics and single-cell transcriptional profiling of CAR-T cells in patients undergoing CD19 CAR-T immunotherapy, Nature communications,2020
美国华盛顿的西雅图佛瑞德•哈金森癌症研究中心、波士顿大学和华盛顿大学
(点此即可查看文献原文)
CAR-T细胞疗法对B细胞恶性肿瘤患者有显著疗效,但我们对其输注后克隆动力学和转录调节特征仍知之甚少。本研究利用 TCRB测序、整合位点分析和单细胞转录组测序(scRNA-seq)分析输注前制品(infusion products,IPs)和输注后患者血液中的CD8+ CAR-T细胞的克隆和基因表达特征。TCRB测序表明CAR-T细胞克隆的多样性在IPs中最高,输注后下降。scRNA-seq表明输注后扩增的克隆主要起源于来自具有较高细胞毒性和增殖基因表达的细胞簇,揭示输注后与CAR-T细胞克隆行为相关的转录特征。
利用TCRB测序进行输注前后克隆型多样性分析
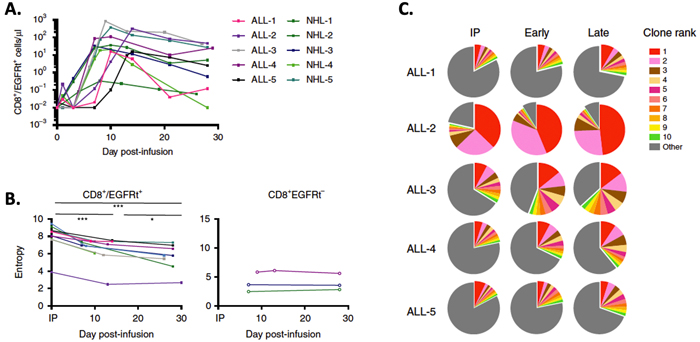
本研究选取接受CD19 CAR-T治疗的10名患者,其中为5名急性淋巴细胞白血病(ALL)患者和5名非霍奇金淋巴瘤患者(NHL),分别对其CAR-T输注制品 (IPs)、输注后早期(7-14天)和晚期(26-30天)的血液样本进行CD8+细胞计数及高通量TCRB测序。结果显示,输注细胞大量增殖发生在输注早期,随后细胞增殖下降,细胞数量减少;TCRB测序分析克隆型,发现IPs和输注早期的克隆型多样性是最高的,随着时间的增长而下降。
A.CAR-T细胞(CD8+/EGFRt+)在IPs和输注后不同时间的细胞增殖情况
B. CAR-T与内源T细胞(CD8+EGFRt-)在IPs和输注后不同时间的克隆多样性
C. 部分病人Top10克隆型占所有克隆型中的比例,不同颜色代表不同克隆型
单细胞转录组分析不同时期病人CAR-T细胞的基因表达特征
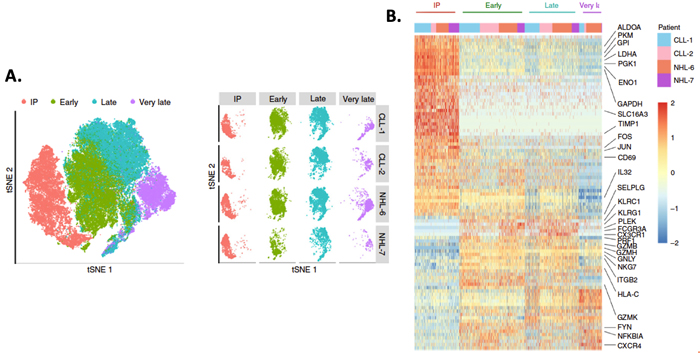
为了进一步探究CAR-T细胞在输注后不同时期(IP、早期、晚期、超晚期83-112天)的基因表达特征,对另外的2名慢性淋巴细胞白血病(CLL)和2个非霍奇金淋巴瘤(NHL)患者进行单细胞转录组测序,以EGFRt基因表达筛选细胞。测序结果显示,在输注前后基因表达特征差异很大:IP期表达基因涉及糖酵解途径、AP-1转录因子及早期活化;输注后早期和晚期表达细胞毒性基因PRF1, GZMB和GZMK;而早期激活的T细胞和效应途径相关基因在晚期和超晚期表达量降低,伴随三羧酸循环及氧化磷酸化途径下降,推测和肿瘤清除后CAR-T细胞数量下降及ATP需求降低有关。
A. 左图:4位患者共62167个 CD8+ CAR-T细胞的tSNE图,不同时期用不同颜色表示;右图:4个病人在不同时期中细胞tSNE图
B. 不同时期CD8+ CAR-T细胞的基因表达热图
单细胞转录特征与克隆型关联分析
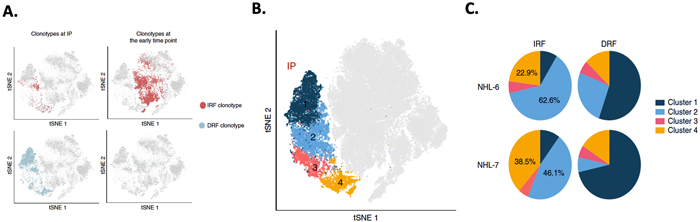
是什么因素影响了输注后的克隆型扩增呢?团队率先分析但排除了慢病毒基因组整合位置的影响。接着通过单细胞转录组结果发现,IPs 中的CAR-T细胞可根据其基因表达特征分成4簇:T细胞活化相关、细胞毒性相关、线粒体相关及细胞周期/增殖相关。为了解是否不同基因表达特征是影响输注后克隆扩增的因素,结合转录组测序及免疫组库V(D)J测序的结果分析发现,在输注早期丰度增高(Increased relative frequency,IRF)的克隆型相比于丰度降低(Decreased relative frequency,DRF)的克隆型,其CCL4, CD27等细胞毒性相关基因表达量上升,且将近85%的IRF细胞来自簇2和簇4,这两个细胞簇分别是表达细胞毒性和细胞增殖相关基因的。跟踪患者直到超晚期,结果发现IRF细胞依然存在。这也印证了在IPs中CD27+CD8+ T比例与CCL病人临床疗效相关。
A. IRF克隆型和DRF克隆型在IP时期和输注早期中的分布概况
B. IPs时期CD8+ T细胞再分成4个细胞簇,以不同颜色代表
C. 2个NHL病人其IRF和DRF中IP时期4个细胞簇所占比例
利用CRISPR-Cas9编辑T细胞治疗难治性肿瘤患者
CRISPR-engineered T cells in patients with refractory cancer,Science,2020
美国宾夕法尼亚大学佩雷尔曼医学院和斯坦福大学医学院(该研究共同通讯作者之一是癌症免疫疗法知名科学家、CAR-T细胞疗法先驱Carl June教授)

使用CRISPR-Cas9进行靶向基因编辑,包含增强表达肿瘤抗原识别TCR以及敲除抑制性受体PD-1,均在体外试验得到证实可增强T细胞毒杀肿瘤能力,具有扩大细胞治疗应用的潜力。然而到目前为止,CRISPR-Cas9编辑的T细胞输注入人体后的安全及可行性尚不明确。美国宾夕法尼亚大学Edward A. Stadtmauer等研究人员首次开展人体I期临床试验,利用多重编辑后的TCR-T细胞治疗3名难治性癌症患者。试验结果显示,修饰后的T细胞-“NYCE”表现出了较强的杀瘤能力,并可在体内持续留存长达9个月,初步阐明CRISPR基因编辑用于癌症免疫治疗的可行性。
多重编辑TCR-T细胞“NYCE”
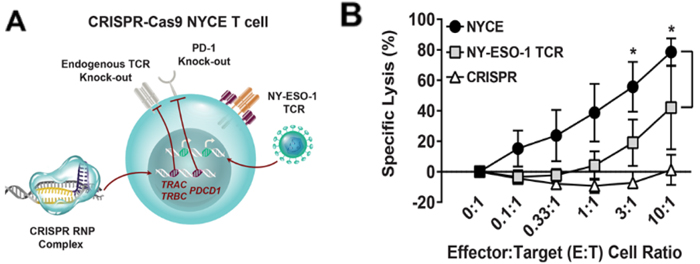
NYCE(NY-ESO-1 transduced CRISPR 3X edited cells)细胞与CAR-T细胞和传统TCR-T的改造不同,首先使用CRISPR-Cas9去除三个基因:前两次编辑去除了2个T细胞的内源TCR基因TRAC和TRBC,利于重编程TCR的正确表达使其能够靶向寻找并消灭肿瘤;第三次编辑删除了PDCD1,限制免疫检查点配体 PD-L1 和 PD-L2触发的 T 细胞耗竭的发生。接着使用慢病毒插入肿瘤特异性T细胞受体来完成第四次基因修饰,使其表达靶向NY-ESO-1和LAGE-1肿瘤抗原肽的特异性TCR。编辑后的T细胞在体外培养至1010以上后收获为输注品。通过流式细胞仪及ddPCR检定,表达重编程TCR的T细胞占2%-7%;TRAC、TRBC和PDCD1的编辑效率各为45%,15%及20%。在体外与靶细胞共培养实验中,NYCE细胞相较于仅CRPSPR编辑或仅改造TCR的细胞,展现了更高的肿瘤毒杀能力。
A.CRISPR-Cas9编辑NYCE细胞示意图
B. NYCE细胞相较仅基因编辑或仅改造TCR的细胞展现了更高的肿瘤毒杀能力
NYCE细胞能在患者体内长期稳定存在且无明显不良事件
将扩增后的细胞终产品(IPs)以108/kg剂量回输到三名患者体内,均未发生急性不良反应且直至三个月都还能观察到NYCE细胞的存在。使用受试者特异性分段线性模型计算输注细胞半衰期平均为83.9天,较先前报道TCR-T细胞的一周半衰期,NYCE细胞在体内更稳定持久。评估多重编辑的安全性,首先观察TCRISPR-Cas9脱靶效应,多半发生在靶点±100bps位置,极少数发生在其他基因如TRBC编辑影响CLIC2、ZNF609和非编码RNA基因LINC00377,然而并未观察到细胞转化或异常扩增;其次检验染色体重排,结果发现除了患者UPN39中一段9.3kB的TRBC1:TRBC2缺失,其他染色体重排事件的频率在体外细胞扩增时期随培养过程逐渐降低,到患者回输后第30、150及170天未检测出染色体重排。
三名患者回输后血液中NYCE细胞量,横坐标为天数
单细胞测序探究TCR-T细胞输注前期和后期细胞类型与基因表达情况
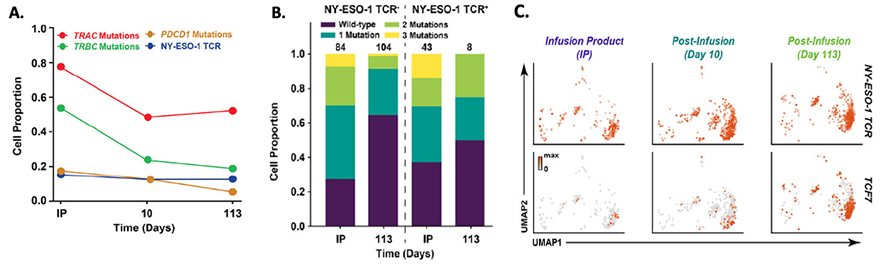
选择移植效果较好和有明显肿瘤治疗效果的NPN39的病人进行单细胞5’端转录组测序并分别对单细胞文库中的NY-ESO-1 TCR、TRAC、TRBC 和PDCD1靶向扩增,以探究输注前后细胞的突变基因型、基因表达特征和细胞类型变化。测序结果显示,在IP中有70%细胞携带1-3个编辑突变,而野生型细胞占30%;输注后10天和113天,不管是否表达NY-ESO-1,编辑后细胞占比下降并维持在约40%。锁定观察NY-ESO-1 TCR细胞的基因表达及突变情况,发现PDCD1基因被编辑删除的细胞占比从IP时期的25%,到输注113天后变为5%,这和先前研究指出缺少PD-1的T细胞建立细胞记忆能力弱是相一致的;此外,随着输注时间的发展,和中央记忆(central memory)相关的基因IL7R和TCF7的表达量显著提升,这和前人的研究中发现NY-ESO-1 T 细胞在输注后有终止增殖和T细胞耗竭趋势的现象是相反的。说明TCR-T细胞在输注后期仍可保持较高的增殖能力。
A.输注前后不同编辑突变细胞占比折线图
B. 表达与不表达NY-ES0-1 TCR的细胞在IP时期和输注后113天,突变细胞占总细胞比例对比
C. IP和不同输注时期 NY-ES0-1 TCR 和 TCF7基因表达tSNE映射图
小编总结
在第一篇CAR-T文章当中,利用单细胞转录组和免疫组库测序技术对CAR-T细胞输注到患者体内前后的克隆型多样性变化、输注后不同时期细胞基因表达特征和具体何种细胞类型会有更强的克隆动力进行了深入、细致的探究,为CAR-T细胞的治疗效用改进和提升奠定了重要基础。
第二篇文章探究了CRISPR-Cas9编辑的TCR-T细胞在人体临床实验的安全性和可行性,利用单细胞测序对编辑后细胞编辑突变比例、基因表达及体内动态特征有了初步了解,虽然本次突破性研究的临床对象数量较少,研究成果仍然意义重大。小编觉得本研究还可进一步比较在肿瘤微环境和外周血中循环TCR-T细胞的基因表达差异。
通过这两篇文章,我们看到单细胞测序在生物制品研发工艺上所能给出的价值,而其应用场景远不止在细胞治疗上,还可以被广泛的运用到抗体研发、疫苗开发、疫苗/药物注射后效用评价和各类疾病/肿瘤的机制研究上。