肠道菌群可以帮助“星星的孩子”恢复健康吗?
【2020-09-12】
在我们身边,大约每800个孩子中,就有这样一位宝宝:他们大多是男孩,常常不愿与他人有目光接触,也不善语言沟通,对周围人的情绪缺乏反应,好像一直沉浸在自己的世界里,常重复同一个动作或同一句话。他们就是“来自星星的孩子”,也是被世界上无数科学家、医生关注的孩子。20世纪中期,精神和神经科医生Hans Asperger和Leo Kanner首次描述了这种疾病的特征,并称之为自闭症谱系障碍(autism spectrum disorders,ASD),也就是我们常说的自闭症或孤独症,是一种较为严重的广泛性发展障碍疾病。

了解儿童自闭症
儿童自闭症的特点是重复、刻板和常常受限的行为,比如点头、难以观察他人的情绪并与之交流。这些行为表现一般在孩子3岁前出现,有的患儿6~24个月就有症状表现。儿童自闭症是一种多因素导致的综合征,包括遗传因素、病毒感染、免疫异常、营养缺乏、重金属代谢异常,以及父母疾病和年龄等。在中国,自闭症的儿童比例并不算高,大约是800:1,但越来越多的家长关注到自闭症问题。在全球范围内,每160名儿童中间就有1人受此病困扰,而在美国,大约每59名儿童中有1名被诊断为自闭症。
自闭症患儿肠道问题与菌群移植治疗
自闭症患儿除了有行为问题外,还常伴有胃肠道问题。研究发现63%的自闭症患儿有腹痛、腹泻或便秘等胃肠道问题,这使科学家联想到,肠道菌群是否可以在自闭症的病因探究和治疗中起到一些作用呢?
答案或许就在今年1月份的《自然》杂志上,因为它上面记录了一位名叫Ethan的宝宝的故事。
小Ethan在不到1岁的时候,因为要治疗耳部感染,服用了几个疗程的抗生素,之后便出现了气味难闻的酸性腹泻,并伴有疼痛和痉挛。1岁的时候,Ethan仍迟迟无法开口说话,也不再跟人进行眼神交流,不久就被确诊为自闭症。

一位自闭症患儿在午餐期间,使用符号进行交流。
来源:SIP/UIG via Getty
自闭症患儿的生存困难程度是无法想象的。小Ethan一直有消化问题,还会在有陌生人的环境中用手捂住耳朵,手足无措,出现不愿意待在人群中的表现。幸运的是,Ethan爸爸带着他参加了亚利桑那州立大学的“微生物群移植疗法”实验。
科学家们给Ethan服用了两周的抗生素万古霉素,来清除肠道内原有的细菌,然后把健康孩子的菌群重新定殖到Ethan的肠道内。Ethan在后续的7~8周的时间里,每天还会喝一杯混合了蔓越莓汁和微生物的特制饮料,同时利用解酸药中和胃酸,来提高新微生物存活的几率。跟Ethan一同参与实验的,还有另外17名小伙伴。
几个月后,Ethan的生活发生的巨大的变化,他的腹泻和痉挛问题消失了。他会在早晨笑着醒来,大喊“早上好!”。他开始对周围的事物感兴趣了,关心“天为什么是蓝的?云为什么是白的?”。他可以在社交技能测试中,表现得跟健康的孩子一样。
一同入组的其他孩子,也展现出了跟Ethan相同的改变,他们的胃肠道症状减少了80%,并且这样的改善效果在某些孩子身上持续了两年之久。
这项粪菌移植治疗儿童自闭症的实验,初期效果是令人振奋的。或许自闭症治疗的曙光就在肠道菌群上,但亚利桑那州立大学的科学家们同样强调“在完成更大规模、包含对照组的试验之前,一切都非定数。”
自闭症患儿肠道菌群结构特点的研究
为了弄清楚肠道菌群与自闭症的关系,科学家们做了很多方向的探索,其中自闭症患儿与健康儿童的肠道菌群结构差异,就是研究的热点之一。
早在2010年,Finegold等人就采用焦磷酸测序的方法对33例有胃肠道症状的自闭症患儿的肠道菌群进行观察,发现严重自闭症患儿粪便中脱硫弧菌(Desulfovibrio)和普通拟杆菌(Bacteroides vulgatus)的数量明显增高。
今年2月份,Lucía Iglesias–Vázquez等人对前人的18项研究进行了荟萃分析,总结了全球493例自闭症患儿和404例健康对照儿童的肠道菌群结构研究结果。分析发现自闭症儿童肠道内拟杆菌属(Bacteroides)、Parabacteroides、梭菌属(Clostridium)、栖粪杆菌属(Faecalibacterium)和Phascolarctobacterium丰度明显增高(下图红色框),而粪球菌属(Coprococcus)和双歧杆菌属(Bifidobacterium)的丰度相对较低(下图绿色框)。
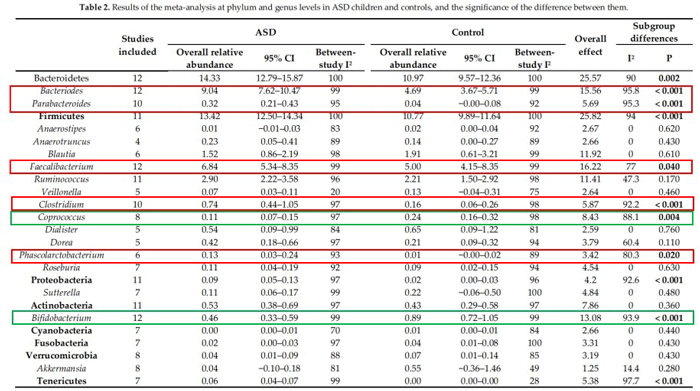
自闭症患儿菌属丰度比较
数据来源:Nutrients
虽然肠道菌群的结构变化是发病的原因还是疾病的结果尚不能判定,但科学家们高度怀疑肠道菌群异常所导致的代谢紊乱是儿童自闭症的发病机制之一。
肠道菌群通过调节中枢神经系统影响自闭症行为
肠道菌群与宿主的双向信息交流网络关系常被描述为各式各样的“轴”,如“肠-肝轴”、“肠-脑轴”、“肠-肺轴”、“肠-肾轴”等。其中肠道菌群就是通过“肠-脑轴”影响中枢神经系统,进而影响全身代谢甚至行为。肠道菌群和大脑之间的沟通途径是一个复杂的网络,肠道菌群通过神经途径、内分泌途径、免疫途径及代谢途径参与肠道和中枢神经系统的双向调节。
那么,肠道内的哪些菌群,影响了自闭症行为呢?
埃及亚历山大大学医学院做了一个自闭症患儿与其兄弟姐妹菌群结构的比对实验,研究发现,在拟杆菌和瘤胃球菌的相对丰度、普雷沃氏菌门/拟杆菌门(P/B)和厚壁菌门/拟杆菌门(F/B)的比值等数据上,自闭症患儿与他的兄弟姐妹没有明显的差别。而唯一区别是,他们的兄弟姐妹体内双歧杆菌含量明显较高,似乎是双歧杆菌为他们提供了一种保护作用。Bercik的小鼠实验也有同样的发现,喂饲双歧杆菌可以改善小鼠的焦虑和少有社交的行为。
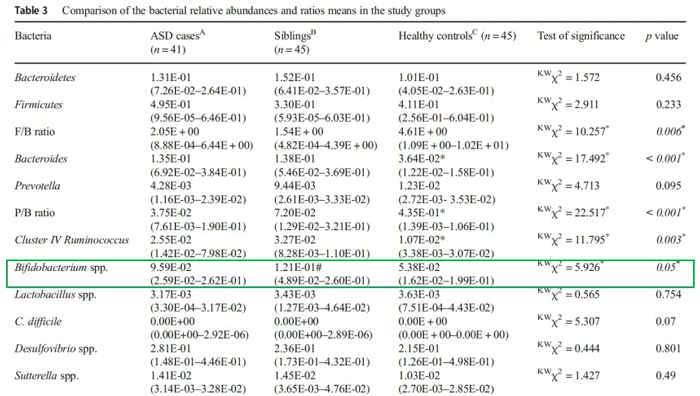
自闭症患儿的兄弟姐妹肠道内双歧杆菌的丰度更高
数据来源:Journal of Molecular Neuroscience
与双歧杆菌的保护作用相反,脱硫弧菌很可能是诱发儿童自闭症的因素之一。研究发现,脱硫弧菌可产生多种有害物质,如丙酸(PPA)、脂多糖(LPS)和硫化氢。丙酸可通过调节神经递质(如多巴胺)导致小鼠社交行为受损,脂多糖和硫化氢在一定条件下对肠道细胞有毒害作用。多项研究发现,与正常儿童相比,脱硫弧菌在自闭症患儿肠道内更常见,说明脱硫弧菌很可能会通过所产生的有害物质诱发患儿自闭症样行为和肠道疾病。
破伤风梭菌也是一种与儿童自闭症相关的有害细菌。它可以产生强效神经毒素,通过迷走神经传入中枢神经系统,水解突触囊泡的小突触泡蛋白,抑制神经递质的释放,从而引起了孤独症的各种行为表现。
目前已知的与儿童自闭症相关的有益菌群主要有双歧杆菌属细菌、艾克曼属细菌和魏斯氏属细菌,有害菌群则包括梭菌属细菌、费氏杆菌、萨特氏属细菌、脱硫弧菌和酵母菌等。
虽然很多研究发现了肠道菌群可以影响患儿的自闭症样行为,但由于肠道菌群的生理功能还没有完全了解,自闭症患儿的肠道菌群特征也没有被详细定义,所以利用肠道菌群治疗自闭症的道路仍然任重道远。但不可忽视的是,口服益生菌及饮食管理的治疗方法,因其非侵入性且没有副作用的优势,值得更多的医生和家长重视,而了解患儿的肠道菌群结构,则是给患儿做个性化调理的第一步。
随着《国民经济和社会发展“十三五”规划纲要》、《“健康中国2030”规划纲要》和《关于印发全国出生缺陷综合防治方案的通知》的提出,国家卫健委将重点出生缺陷疾病纳入综合防控方案,着力建立完善出生缺陷防治体系。出生缺陷严重影响儿童的生存和生活质量,给患儿及其家庭带来巨大痛苦和经济负担。9月12日是中国预防出生缺陷日,今年的主题是“同心抗疫,护佑新生”,我们期待全社会共同努力、积极行动,全面加强出生缺陷防治,切实维护和保障妇女儿童健康,不断提高出生人口素质,促进经济社会可持续发展。
参考文献
[1] Svoboda E.(2020).Could the gut microbiome be linked to autism.Nature.DOI:10.1038/d41586-020-00198-y
[2] Iglesias-Vázquez Lucía, et al. (2020).Composition of Gut Microbiota in Children with Autism Spectrum Disorder: A Systematic Review and Meta-Analysis. Nutrients.DOI:10.3390/nu12030792
[3] Ahmed S.,et al.(2020). Study of the gut Microbiome Profile in Children with Autism Spectrum Disorder: a Single Tertiary Hospital Experience.J. Mol. Neurosci.DOI:10.1007/s12031-020-01500-3
[4] Bezawada N.,et al.(2020) Autism Spectrum Disorder and the Gut Microbiota in Children: A Systematic Review. Ann. Nutr. Metab. DOI:10.1159/000505363
[5] Ribeiro R.,et al.(2019) Impact of vitamin deficiency on microbiota composition and immunomodulation: relevance to autistic spectrum disorders. Nutr Neurosci. DOI:10.1080/1028415X.2019.1660485
[6] 邹荣,等.(2020)肠道菌群与儿童自闭症谱系障碍关系的研究进展.中华神经医学杂志. DOI: 10.3760/cma.j.cn115354-20190520-00280
[7] Finegold S. M.,et al.(2010).Pyrosequencing study of fecal microflora of autistic and control children.Anaerobe.DOI:10.1016/j.anaerobe.2010.06.008
[8] BercikP,et al.(2011).The anxiolytic effect of bifidobacterium longum NCC3001 involves vagal pathways for gut-brain communication.Neurogastroenterol Motil.DOI:10.1016/s0016-5085(11)60072-3
[9] BolteER.(1998).Autism and Clostridium tetani.Med Hypotheses.DOI:10.1016/S0306-9877(98)90107-4







